Principe zéro (équilibre thermique)
Soit deux systèmes A et B séparés par une paroi diathermique. L'ensemble A+B étant adiabatiquement isolé du milieu extérieur.
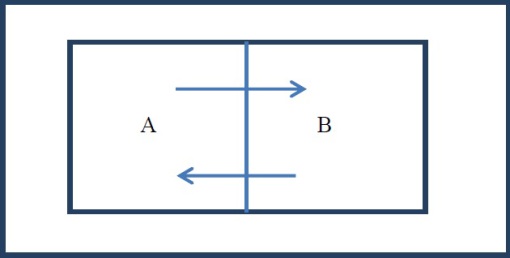
Si les états initiaux des deux systèmes mis en contact étaient différents, il se produirait un échange de chaleur entre eux. Au bout d'un certain temps, on n'observe plus d'échange de chaleur entre ces deux systèmes: on dit qu'ils sont en équilibre thermique.
Ceci nous permet de postuler l'existence d'un paramètre intensif d'état appelé température. Cette dernière prend la même valeur pour les deux systèmes lorsque l'équilibre thermique est atteint.
Donc, le principe zéro peut s'énoncer comme suit :« Deux systèmes en équilibre thermique avec un troisième, sont en équilibre entre eux ».
Energie interne (U)
L'énergie interne d'un système est son contenu en énergie pour ce système. Chaque système (solide, liquide ou gazeux) est une collection d'objets tels des atomes, des molécules,...etc. Ces particules à l'échelle microscopique sont toujours animées de mouvements incessants et aléatoires (agitation moléculaire); dite vibration pour les solides et agitation thermique pour les liquides et les gaz.
A ces mouvements microscopiques est associé de l'énergie cinétique Eci pour chaque particule. De plus, entre ces atomes peuvent exister des forces d'interaction (attraction et répulsion) aux quelles on associe une énergie potentielles Epi pour chaque particule.
A l'échelle microscopique, l'énergie interne (U) du système est définie comme la somme algébriques des énergies cinétiques Eci et potentielles Epi, de toutes les particules formant le système.
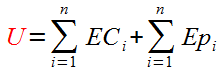
Propriétés de l'énergie interne
A l'équilibre thermique, l'énergie interne (U) :
C'est une énergie exprimée en Joule [J] ou en [cal].
Elle a une valeur bien définie.
C'est une fonction d'état (qui ne dépend que l'état thermodynamique initial et final).
L'énergie interne caractérise le niveau énergétique du système thermodynamique. L'énergie interne d'un système peut varier suite à des échanges d'énergie avec le milieu extérieur. Les énergies sont principalement échangées sous forme de chaleur (Q) et de travail (W).
Définition : La Chaleur (Q)et le travail (W).
La chaleur est une forme spéciale de l'énergie :
C'est une énergie exprimée en [J] ou en k[cal].
Elle est échangée à l'échelle microscopique sous forme désordonnée par agitation moléculaire (c'est-à-dire par choc entre les molécules en mouvement.
Elle s'écoule toujours d'une source chaude vers une source froide.
La chaleur n'est pas une fonction d'état, c'est-à-dire dépend du chemin suivi. [1]
Le travail (W) :
Le travail est une autre forme d'énergie (énergie mécanique) :Le travail résulte le plus souvent d'une variation de volume d'un système déformable (non rigide), par exemple le cas du déplacement d'un piston.
C'est une énergie exprimé en [J] ou en [cal].
A l'échelle microscopique; c'est une énergie échangée de façon ordonnée (grâce au déplacement par exemple d'un piston qui imprime une certaine direction aux atomes.
Ce n'est pas une fonction d'état.
Références Bibliographiques [1]





