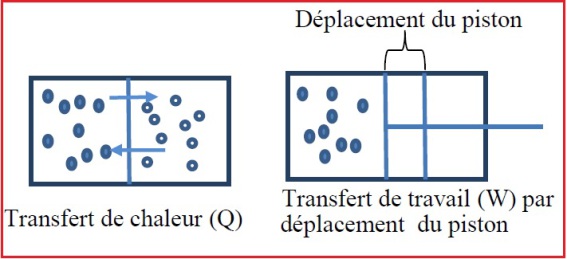
Chaleur et énergie
Les échanges de l'énergie de la matière se présentent sous deux formes possibles; la chaleur (Q) ou le travail (W). Ces deux formes sont interprétées à l'échelle microscopique comme une manifestation de l'agitation des molécules et des atomes sous forme désordonnée (chaleur Q), ou ordonnée (travail W).
La température est une variable qui joue un rôle fondamental en thermodynamique, elle peut être définie de deux façons :
Cinétiquement en se référant à l'énergie cinétique microscopique (agitation thermique)[1]. Autrement dit T est la conséquence macroscopique de cette agitation.
Macroscopiquement en utilisant un thermomètre.(La définition macroscopique fait intervenir le principe zéro)